Patel MR et al and the ROCKET AF steering committee, for the ROCKET AF investigators
N Engl J Med. 2011; 365: 883-91.
PMID: 21830957
ClinicalTrials.gov number: NCT00403767.
【資金提供】
【利益相反COI or 開示disclosure】
本文pp.890に記載。NEJMのページも参照。
背景
ワーファリン®(ワルファリン)使用は心房細動患者における虚血性脳卒中の発生率を低下させるが、頻繁なモニタリング(PT-INR等)と投与量の調整が必要である。経口第Xa因子阻害薬であるイグザレルト®(リバーロキサバン)は、ワルファリンよりも一貫性があり予測可能な抗凝固療法を提供する可能性がある。
結論
心房細動の患者において、リバーロキサバンは脳卒中または全身性塞栓症の予防に関してワルファリンよりも劣っていなかった。 頭蓋内出血および致死的出血はリバーロキサバン群でより少ない頻度であったが、大出血のリスクに有意な群間差はなかった。
ただしワルファリンのPT-INR目標値は2~3であり、日本人の目標値(特に高齢者)における目標値である1.6~2.6と異なるため、日本人への適応については慎重に行う必要があると考えられる。
組入基準
脳卒中リスクが中等度から高の非弁膜症性心房細動患者。心房細動の診断にはECGが用いられた。
リスク評価は、 危険因子(脳卒中、一過性脳虚血性発作、全身性塞栓症、心不全または左室駆出率35%以下、高血圧、75歳以上)のうち少なくとも2つ以上によって示された。
糖尿病の存在(すなわち、1〜6の範囲の尺度で2以上のCHADS2スコア、より高いスコアは脳卒中のより高い危険性を示す)。このプロトコルによれば、以前に虚血性脳卒中、一過性虚血性発作、または全身性塞栓症を発症したことがなく、危険因子が2つ以下であった患者の割合は、各地域のコホートの10%に限定された。残りの患者は、以前の血栓塞栓症または3つ以上の危険因子のいずれかを患っていたことが必要でした。全患者が書面によるインフォームドコンセントを提供した。
除外基準
【心臓関連の症状•血行動態的に有意な僧帽弁狭窄•人工心臓弁(人工リングの有無にかかわらず、弁輪形成術、交連切開術および/または弁形成術)
•計画的な除細動(電気的または薬理学的)•可逆性障害による一過性心房細動(例:甲状腺中毒症、PE、最近の手術、MI)•心房粘液腫または左室血栓の既知の存在•活動性心内膜炎出血リスク関連基準•活動性内臓出血•出血リスクの増加に関連した病歴または病状:以下を含むがこれらに限定されない: – ランダム化訪問の30日前以内の主な外科手術または外傷 – ランダム化訪問の6ヶ月以内の臨床的に有意な消化管出血 – 頭蓋内、眼内、脊髄、または非外傷性関節内出血 – 慢性出血性疾患 – 既知の頭蓋内腫瘍、動静脈奇形、または動脈瘤大手術を含む、制御不能な出血の可能性がある計画的な侵襲的処置•血小板数•持続性無制御高血圧:収縮期血圧≥180mmHgまたは≥径最高血圧≥100 mmHg付随する条件と治療•3ヶ月以内の脳卒中(ランキンスコア4〜5の修正、[添付2]を含む)を無効にする、またはランダム化来院前14日以内の脳卒中•3日以内の一過性虚血発作ランダム化訪問の前•心房細動以外の状態に対する抗凝固療法の適応(例:VTE)•次の治療を受ける – アスピリン> 100 mg /日 – ランダム化前5日以内のチエノピリジンとの併用 – ランダム化前5日以内の静注抗血小板 – 無作為化前10日以内の線維素溶解薬 – 注:アスピリン≤100mg単独療法は許可されており、チエノピリジン単独療法は許可されています。・非ステロイド系抗炎症薬による長期治療の必要性・無作為化前4日以内の強力なチトクロームP450 3A4阻害剤(ケトコナゾールまたはプロテアーゼ阻害剤など)による全身治療、または試験期間中の計画的治療•無作為化前の4日以内に、リファンピン/リファンピシンなどのチトクロームP450 3A4の強力な誘導物質による治療、または研究期間中の計画された治療•貧血(ヘモグロビン3 x ULN研究参加およびフォローアップ関連基準) •2年未満の平均余命に関連する重篤な併発性疾患•無作為化訪問の3年前以内の薬物中毒またはアルコール乱用•計画された治療開始の30日前以内に実験薬物を投与または実験医療機器を使用した。本研究またはその他のRIVA研究におけるランダム化ロキサバン•リバロキサバン、ワルファリン、またはプラセボ賦形剤の任意の成分に対する既知のアレルギーまたは過敏症(ラクトース、微結晶セルロース、ステアリン酸マグネシウム、ヒプロメロース、マクロゴール、クロスカルメロースナトリウム、ラウリル硫酸ナトリウム、酸化チタン/酸化鉄レッド、酸化チタン/酸化鉄レッド) 、無水ラクトース、アルファ化デンプン、FD&Cレッド#6バリウムレーキ、FD&Cイエロー#10アルミニウムレーキ、FD&Cブルー#1アルミニウムレーキ、FD&Cイエロー#6アルミニウムレーキ、コーンスターチ、ラクトース一水和物)手順•研究者または研究センターの従業員、その研究者または研究センターの指示のもとに提案された研究またはその他の研究に直接関与した従業員または研究者の家族)
PICOTS
P: 18歳以上の脳卒中リスクの高い(CHADS₂スコア:2以上)非弁膜症性心房細動患者14,264例
I : リバーロキサバン 20 mg/日(クレアチニンクリアランス30~49 mL/minの場合は 15 mg/日)
C: ワルファリン(INR 2~3になるよう用量調整)
O: primary — (虚血性あるいは出血性) 脳卒中あるいは全身性塞栓症
secondary — 脳卒中、全身性塞栓症、または心血管系疾患による死亡、または心筋梗塞の複合。
safety — 主要および非主要な臨床的に関連のある出血事象の複合
T : ランダム化比較試験、プラセボ対照、非劣性試験(マージン1.46)、優越性についても検討(マージン1.0?記載無し)、追跡期間(中央値)は707日(治療期間は 590日)
S : 45ヶ国、1,178施設
批判的吟味
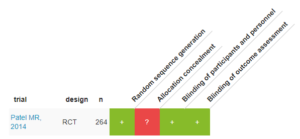
RobotReviewerによる Risk of Bias Table

ランダム割り付けされているか?(観察者バイアスはないか?)
ランダム化されている。
ブラインドされているか?(マスキングにより観察者バイアスは抑えられているか?)
マスキングされている。二重盲検。
隠蔽化されているか?(選択バイアスはないか?)
されていると判断。多施設で実施されているため。
プライマリーアウトカムは真か?明確か?
真であると判断した。ただし複合エンドポイントである点を考慮する必要がある。
交絡因子は網羅的に検討されているか?
概ねされていると判断した。
Baseline は同等か?
概ね同等であると判断した(Table 1参照)。
ITT 解析されているか?
されている。Per Protocol Setについても実施。
ITT:Rivaroxaban 7081名、Warfarin 7090名
PPS:Rivaroxaban 6958名、Warfarin 7004名
追跡率(脱落)はどのくらいか?結果を覆す程か?
両群とも追跡率80%を割っており、少し脱落が多いという印象。
エンドポイントイベント前および終了日前に割り当てられた治療を永久に中止した患者の割合は、リバーロキサバン群で23.7%、ワルファリン群で22.2%だった。
追跡調査に失敗した患者は32人のみ。 Good Clinical Practiceガイドライン違反のためデータの信頼性が低い施設が1つあったため、93人の患者(リバロキサバン群で50人、ワルファリン群で43人)が盲検前にすべての有効性分析から除外された。
データ品質に関する別の問題が他の試験施設で提起されたが、この問題は分析から患者を除外することなく解決された。
サンプルサイズは充分か?
サンプル必要数14,000、必要イベント数363と計算された。実際の症例数と primary event数が充分。
一次分析では、片側αレベル =0.025、パワー95%で非劣性マージン1.46を計算するために、最低363イベントが必要と判断。ただし、堅牢な統計結果を保証するために、405イベントが事前設定された。ワルファリン群の100患者年あたりの予測イベント発生率2.3%および年間消耗率の予測14%に基づいて、約14,000人の患者を無作為に試験群に割り当てる必要があると推定された。100患者年あたりの発生率は、1年あたりの患者の割合として表された。ハザード比、信頼区間、およびP値は、唯一の共変量として治療法を用いたCox比例ハザードモデルを用いて計算した。非劣性の検定は、片側有意水準0.025に基づいた。優位性の検定は、両側有意水準0.05に基づいた。
結果は?
一次エンドポイント
・ITT解析
リバーロキサバン群の188人(年間1.7%)およびワルファリン群の241人(年間2.2%)で発生した。
ハザード比 =0.79
95%信頼区間[CI]0.66~0.96
非劣性 P<0.001
・PPS
リバロキサバン群の269人(年間2.1%)およびワルファリン群の306人(年間2.4%)で発生した。
ハザード比 =0.88
95%CI 0.74〜1.03
非劣性 P<0.001; 優越性 P =0.12
・出血
リバロキサバン群で1475人(年間14.9%)およびワルファリン群の1449人(年間14.5%)で発生した。
ハザード比 =1.03
95%CI 0.96~1.11
P =0.44
リバロキサバン群における頭蓋内出血および(0.5% vs. 0.7%, P =0.02)および致死的出血(0.2% vs. 0.5%, P =0.003)が少なかった。
コメント
久しぶりの批判的吟味。
以前ニュースになっていましたがRocket-AFで用いられたINR測定機にリコールがありました。
つまり測定器の動作不良のためワルファリン群のINRが本来より低くなり、ワルファリンが増量されたため、見かけ上リバーロキサバン群の出血が少なくなった可能性があるということです。 本論文で致死的出血や頭蓋内出血についてリバーロキサバン群で少なかったのも、ワルファリンが過量であったためではないかと考えらます。
これに対し2016年のNEJMに再解析・反論論文が掲載されました。(https://www.nejm.org/doi/10.1056/NEJMc1515842)
もう少し詳細にみていくと、ヘマトクリット値の異常やファブリノーゲン値の上昇,出血等がある患者において、本試験で用いられたINR簡易検査器で測定した場合、検査機関で測定した値よりもINRが低値を示す可能性が示唆された。
再解析結果では、上記の特定患者(約5,000例)を除いても両群間でプライマリーアウトカムに差は認められなかった。しかし本試験は非劣性試験であるため、例数が少なくなることで、より非劣性を達成しやすくなる。したがって再解析で、元の解析結果と同様な結果であったとしても、再解析結果はあくまで仮説生成になってしまうということ。
さらには元の解析結果はサンプルサイズが足りないことになり、本当に非劣性であったのか、サンプルサイズが足りないために見かけ上、非劣性を示せたのか非常に曖昧となってしまった。
また日本ではバイエル社がイグザレルト®を含む自社販売医薬品の副作用報告を怠っていたとして、2017年9月に厚生労働省より改善指導が行われました(https://www.mixonline.jp/Article/tabid/55/artid/59021/Default.aspx)。
副作用報告遅延86件のうち、イグザレルト®に関する報告は77件。ほぼイグザレルト®ですね。
つまり現時点では、リバーロキサバンはワルファリンに有効性の面で劣っていないとはいえず、副作用の面において優れているとは言えないと個人的には考えています。
ーーーEvidence never tells you what to do, people doーーー
]]>

コメント