High-Dose Versus Low-Dose Pitavastatin in Japanese Patients With Stable Coronary Artery Disease (REAL-CAD): A Randomized Superiority Trial. Taguchi I et al. Circulation. 2018 May 8;137(19):1997-2009. doi: 10.1161/CIRCULATIONAHA.117.032615. PMID: 29735587 CLINICAL TRIAL REGISTRATION: NCT01042730.
Disclosure開示
本文2,006ページに記載Funding資金提供
保健研究財団の生活習慣病総合臨床支援プロジェクトが本研究に資金を提供した。 治験薬を製造している会社(Kowa Pharmaceutical Co Ltd)は、公衆衛生研究財団のプロジェクトに対して財政的支援を提供する団体の1つであったが、設計、分析、データ解釈、または製造準備に関与していなかった。研究の背景
現行の診療ガイドラインでは、過去に実施されたいくつかの臨床試験(高用量 vs. 低用量スタチン)に基づき、心血管疾患を有す患者を対象に高強度スタチンによる治療を呼びかけている。しかし、アジア人集団を対象としたスタチン用量に対する明確なエビデンスは確立されていない。そこで安定冠動脈疾患患者におけるリバロ®️(ピタパスタチン)4 mg/日と1 mg/日の心血管イベント抑制効果について検証した(優越性試験)。 結論 高用量(4 mg/d)ピタバスタチンは、低用量(1 mg/d)に比べ、心血管イベントを有意に低下させた。組入基準
以下の(1)~(4)を有す患者をRun-inに組み入れた。 (1)冠動脈疾患患者 以下の1)〜3)の基準のうち少なくとも1つを満たす患者: 1)急性冠症候群(急性心筋梗塞または不安定狭心症)の既往歴 2)冠動脈再建術(PCIまたはCABG)を施行された患者 3)米国心臓協会(AHA)分類に基づき、血管造影により少なくとも75%冠動脈狭窄を伴う冠動脈疾患 (2)高コレステロール血症 以下の1)〜3)の基準のうち少なくとも1つを満たす患者: 1)LDL-C 140 mg /dL以上 2)LDL-C 100 mg /dL以上、かつ研究者あるいは研究補佐がコレステロール降下療法を必要と判断した患者 3)既にコレステロール低下薬を服用している患者 (3)インフォームド・コンセント時の年齢が20〜80歳 (4)研究への参加に関する包括的な説明を受け、完全に理解しており、研究に参加するための参加者自身の自由意思の書面による同意を得ている除外基準
次の条件が適用される患者は、参加基準を満たしていても、run-in期間の登録から除外された。 (1)冠動脈再建術が予定されているが、まだ完了していない患者 (2)活動性悪性腫瘍の存在 (3)リバロ®錠に対する禁忌(以下のいずれかの状態)を有す患者 1)リバロ®錠の成分に対する過敏性の病歴 2)重篤な肝障害または胆管閉塞 3)現在、シクロスポリンで治療中 4)妊娠している、妊娠している可能性のある、または授乳中の女性 (4)重篤な心不全(左心室駆出率30%未満またはNYHA分類クラスIII以上) (5)透析中 (6)家族性高コレステロール血症 (7)現在別の臨床試験に参加中 (8)現在中止困難な禁忌併用薬による治療中 (9)研究者または研究補佐の判断あるいは、その他の理由により、試験参加が不適格であるされた患者PICOTS
P:平均年齢68歳の高コレステロール血症を有す冠動脈疾患患者 I:ピタバスタチン 4 mg/日(LDLコレステロール低下の程度はアトルバスタチン 20 mgに相当) C:ピタバスタチン 1 mg/日(アトルバスタチン 5 mgに相当) O:Primary — 複合アウトカム(①心血管死、②非致死性心筋梗塞、③非致死性脳卒中、④緊急入院を要する不安定狭心症) Secondary — Primary outcome + 冠動脈血行再建術(ただし再狭窄による再治療である標的病変血行再建は除外された)、有害事象 T:治療・予防、PROBE法(前向き、ランダム化、オープンラベル、エンドポイント評価者はブラインド)、優越性試験(両側5%) S:多施設(日本の28施設)、対象は日本人のみ、2012〜2016年フォロー批判的吟味
研究デザインは?ランダム化されているか? ランダム化されている ランダム割付が隠蔽化されているか?(selection bias は無いか?) されていると判断した(電子データ収集システムを利用) 施設、年齢(65歳未満、65歳以上)、性別、糖尿病、組入前のスタチン使用状況に基づき層別化された(動的割付) マスキングされているか?(ブラインドか否か?) オープンラベル(エンドポイント委員会はブラインド) 交絡因子は網羅的に検討されているか? 概ね検討されている Baseline は同等か? ほぼ同等 ITT 解析されているか? Full Analysis Set(FAS) 追跡期間は? 中央値3.9年 サンプルサイズは充分か? 13,054例と充分(FASとしては12,413) 高用量ピタバスタチン治療で相対危険度が16%低下することを想定し、power =80%、α =5%(両側)で合計1033イベントの発生が必要であると算出された。過去の日本の研究に基づくイベント率が2.5%、推定低下率が10%と仮定すると、少なくとも12,600例で3年間のフォローアップが必要であると算出された。結果は?
プライマリーアウトカム(複合アウトカム)
ハザード比HR =0.81 (95%CI 0.69〜0.95), P=0.01
ピタバスタチン1mg — 334イベント (6,214例の5.4%)
ピタバスタチン4mg — 266イベント (6,199例の4.3%)
相対リスクRR =4.3/5.4 =0.796
相対リスク減少率RRR =1-0.796 =0.204
絶対リスク減少率ARR =5.4-4.3 =1.1%
治療必要数NNT = 1/0.011 =90.909 ≒91
セカンダリーアウトカム
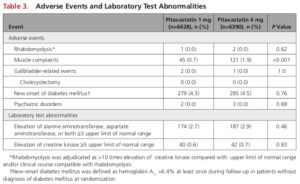
有害事象
 (本文Table 3より引用)
高用量(4 mg/日)で筋肉痛が多い。
ランダム化時に糖尿病を有していなかった患者での糖尿病発症(HbA1cが6.4%超)が両群とも4%を超えていた(フォロー中に1度でもHbA1cが6.5%以上の場合、カウントされた)。
(本文Table 3より引用)
高用量(4 mg/日)で筋肉痛が多い。
ランダム化時に糖尿病を有していなかった患者での糖尿病発症(HbA1cが6.4%超)が両群とも4%を超えていた(フォロー中に1度でもHbA1cが6.5%以上の場合、カウントされた)。
コメント
緊急入院の要否に関わらず狭心症はソフトエンドポイントだと思う。 PROBE方とソフトエンドポイントの組み合わせがあり結果の解釈に注意が必要だが、不安定狭心症による緊急入院には差がなく、ハードエンドポイントである心筋梗塞と全死亡の低下が大きい。一方、脳卒中については増加傾向。-Evidence never tells you what to do-
👇 ポチッていただけますと喜びます。

コメント